医療機器認証部 薬事支援サービス
日本国内で医療機器の製造販売を行うには、PMDAや認証機関に薬事申請を行い、承認・認証を受けなければなりません。その際、その医療機器の有効性・安全性をいかに科学的にかつ論理的に担保されていることを規制当局に対して文書で説明する必要があります。この文書には、医療機器の開発経緯から設計検証・非臨床試験結果・臨床試験結果、製造プロセスでの品質管理および安全性・有効性について科学的データを示す必要があります。
Vtechでは医療機器の開発初期段階から承認・認証審査を見据え、その後の保険適用や拡販戦略までを含めた薬事戦略の立案を行い、遂行します。
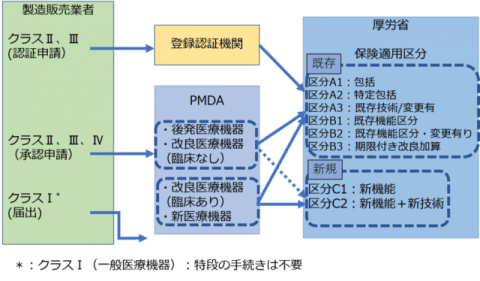
認証・承認フロー
国内で医療機器を製造し、販売する場合の審査フロー
Vtechの薬事戦略
プランニング

医療機器の該当性等の調査や競合製品の調査等を行い、薬事申請、保険適用に向けた戦略プランを立案します。
該当性等の調査
- 製品の仕様の市場調査
- 類似分類品の差分調査
- 各種エビデンス資料を精査
- 使用目的・効果効能のまとめ
- 都道府県薬務課への該当性確認
薬事戦略準備
- 競合調査
- 市場性調査
- 業取得申請の必要書類精査
- 海外での状況確認
- QMS対応への現状確認
- 臨床・非臨床試験の要否検討
薬事戦略立案
医療機器のクラス分類について
医療機器は、その使用により身体への侵襲性(物理的な負担や影響による人体へのリスク)の程度により下記記のように分類されます。
また、その分類によりその医療機器の承認・認証等を行う機関が異なります。(上記の薬事フローを参照ください)
クラス分類 | 定義 |
クラスⅣ 高度管理医療機器 | 患者への侵襲性が高く不具合が生じた場合、生命の危険に直結する恐れがあるもの。 |
クラスⅢ 高度管理医療機器 | 不具合が生じた場合、人体へのリスクが比較的高いと考えられるもの。 |
クラスⅡ 管理医療機器 | 不具合が生じた場合、人体へのリスクが比較的低いと考えられるもの。 |
クラスⅠ 一般医療機器 | 不具合が生じた場合、人体へのリスクが極めて低いと考えられるもの。 |
保守、設置、所在の把握などが必要な医療機器
下表の定義に該当する機器については、特性に応じて追加で遵守すべき事項が規定されています。
- 特定保守管理医療機器: 販売業・修理業の許可等が他と異なることがあります。
- 設置管理医療機器:設置管理基準所の作成や配布等が義務付けられています。
- 特定医療機器:他の医療機器よりも症例において多くの要求がされています。
分類 | 定義 |
特定保守管理医療機器 | 保守点検、修理その他の管理に専門的な知識及び技能を必要とすることからその適正な管理が行わなければ疾病の診断、治療又は予防に重大な影響を与える恐れがあるものとして厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定する医療機器。 |
設置管理医療機器 | 設置に当たって組立が必要な特定保守管理医療機器であって、保健衛生上の危害の発生を防止するために当該組立に係る管理が必要なものとして厚生労働大臣が指定する医療機器 。 |
特定医療機器 | 人の体内に植え込む方法で用いられる医療機器であって、保健衛生上の危害の発生又は拡大を防止するためにその所在が把握されている必要のあるものとして厚生労働大臣が指定する医療機器。 |
業許可申請
製造販売業許可
製造販売業者は医療機器の設計開発や実際の製造から販売・使用、品質・安全性までの全責任を持つことが求められ、その体制が整っているかどうかが審査されます。
【要件】
- 製造管理・品質管理(QMS)体制の構築(QMS体制省令)
- 製造販売後の安全管理(GVP)の運用(GVP省令)
【有効期限】 5年
【許可検者】総括製造販売責任者が勤務する事業所が所在する都道府県知事
【区分】
区分 | 製造販売可能なクラス |
第一種 | 全てのクラス分類の医療機器を製造販売できる |
第二種 | クラスⅠ、Ⅱのみを製造販売できる |
第三種 | クラスⅠのみ製造販売できる |
QMS体制省令
QMS省令を遵守するために必要な体制を定めたもの。
1.組織の体制整備
- 品質管理監督システムの確立
- 品質管理監督システムの文書化及び実施並びにその実効性の維持
- 品質管理監督文書の管理
- 品質管理監督記録の管理
2.適切な人員の配置(三役)
| 三役 | 責任範囲 |
|---|---|
総括製造販売責任者 | 製造販売業の総括製造販売責任者(通称︓総責)とは、製造販売業において製品の出荷の決定その他の製造管理及び品質管理に係る業務を統括し、これに責任を負う |
| 国内品質業務運営責任者 | 製造販売業の国内品質業務運営責任者(通称︓品責)とは、国内の製品の品質を管理する業務(品質管理業務)を行う責任者として、国内の品質管理業務を適正かつ円滑に遂行するための品質保証部門の責任者 |
| 安全管理責任者 | 製造販売業の安全管理責任者(通称︓安責)とは、安全確保業務の適正かつ円滑に遂行するための安全管理(統括)部門の責任者 |
GVP省令
医療機器を含む医薬品等の品質、有効性及び安全性に関する事項その他適正な使用のために必要な情報の収集、検討及びその結果に基づく必要な措置の方法を定めたものです。
製造販売業者は、本省令に従い、いち早く不具合等の情報を掴みとり、危害防止のための対応(販売停止、回収、医療機器の改良、添付文書の改訂等)が求められます。
製造販売業者は、本省令に従い、いち早く不具合等の情報を掴みとり、危害防止のための対応(販売停止、回収、医療機器の改良、添付文書の改訂等)が求められます。
製造販売業承認、製造販売業認証
医療機器は、その使用に当たり診断、治療に求められる性能・効果を正しく発揮するとともに、診断、治療において不具合等が生じないよう、品質・有効性・安全性が確保されたものであることが必須です。
承認又は認証を受ける際は、予め、医療機器としての評価がされる他、製造販売業者が行う医療機器の品質管理がQMS省令の基準に適合していることが必要となります。
QMS省令への適合
QMSとは品質マネジメントシステム(Quality Management System)のことで、製造販売業者が企業としてシステム(組織体制やルール)を確立し、製造も含めた製造販売に関わる組織全体で品質保証(製造管理及び品質管理)を行うことをいいます。
特に、管理監督をすべき者(例えば医療機器の製造販売に責任を持つ取締役など)を中心としたPDCAサイクルを回すことにより、常に適切な品質の医療機器を市場に供給し続ける必要があります。
特に、管理監督をすべき者(例えば医療機器の製造販売に責任を持つ取締役など)を中心としたPDCAサイクルを回すことにより、常に適切な品質の医療機器を市場に供給し続ける必要があります。
QMS適合性調査対象は、設計・開発、主たる組立、滅菌、最終保管、製造販売業者になります。
QMS適合性調査の項目としては
- 基本要件基準への適合性
- 適合性認証基準への適合性
- 品質管理基準への適合性
* 承認或いは認証については上の薬事フローを参照下さい。クラス、認証基準の有無により変わります。
製造業者登録
実際に製造する製造所ごとに登録が必要です(対象となる製造工程は、設計、主たる組立、滅菌、最終製品の保管をする工程)。
製造した製品は、製造の次工程を担う製造業者や製造販売業者にのみ出荷できます(製造販売業者から市場への出荷について委託を受けている場合は、この限りではない)。
製造所では、製造販売業者の管理監督の下、QMSによる製造管理及び品質管理が求められます。
【有効期限】5年
【登録検者】責任技術者が勤務し、製造所が所在する都道府県知事
【登録が必要な製造工程】設計・開発、主たる組立等、滅菌、国内における最終製品の保管
【要件】責任技術者
保険適用
保険適用を受けるためには、製造販売業者が承認・認証取得後、区分に従って保険適用申請書を医政局経済課に提出する必要があります。
保険適用希望書について
| 様式 |
|
| 添付資料 (区分A2,B1/2) |
|
- A1,A2,A3に該当する保険医療材料は、診察報酬項目の中にふくまれるので製品の価格を保険請求できない
- B1,B2,B3に該当する保険医療材料は機能区分ごとに価格が決められており技術料とは別に保険請求することができる
- C1,C2に該当する医療保険材料はB区分と同様に保険請求できる。しかし、承認時に新たな機能区分が必要となる